
I. Законодательство
В соответствии с Законом об обеспечении качества, эффективности и безопасности продукции, включая фармацевтические препараты и медицинские изделия (далее — ?Закон о фармацевтических препаратах и медицинских изделиях?), управление лекарственными средствами имедицинское устройствов Японии осуществляется в соответствии с этим законом. Закон о фармацевтических препаратах и медицинских изделиях был изменен на основе первоначального Закона о фармацевтических препаратах, и его конкретные положения включают в себя Постановление об исполнении Закона о фармацевтических препаратах и медицинских изделиях, Постановление о системе менеджмента качества (QMS) и другие соответствующие объявления и уведомления.
II. Ведомства
Управление лекарственными средствами и медицинскими изделиями в Японии осуществляется в основном двумя ведомствами: Министерством здравоохранения, труда и благосостояния Японии (MHLW) и Национальным агентством по контролю за качеством и безопасностью лекарственных средств и медицинских изделий (PMDA).
III. Классификация медицинских изделий
(1) Медицинские изделия общего назначения (ClassⅠ):Назначаются министром здравоохранения, труда и благосостояния Японии после консультации с Советом по фармацевтическим препаратам и санитарии пищевых продуктов. Риск для жизни и здоровья человека при возникновении побочных эффектов или функциональных нарушений у таких медицинских изделий относительно невелик.
(2) Медицинские изделия, подлежащие контролю (ClassⅡ):Также назначаются министром здравоохранения, труда и благосостояния Японии после консультации с Советом по фармацевтическим препаратам и санитарии пищевых продуктов. При возникновении побочных эффектов или функциональных нарушений у таких медицинских изделий существует вероятность негативного влияния на жизнь и здоровье человека, поэтому необходим надлежащий контроль.
(3) Медицинские изделия, подлежащие строгому контролю (ClassⅢ, ClassⅣ):При возникновении побочных эффектов или функциональных нарушений у таких медицинских изделий существует серьезный риск для жизни и здоровья человека, поэтому необходим строгий контроль.

IV. Модели сертификации медицинских изделий и порядок проверки регистрации
Иностранные производители, желающие экспортировать свои изделия в Японию, должны пройти регистрацию в Министерстве здравоохранения, труда и благосостояния Японии. Эта процедура называется регистрацией иностранных производителей (FMR). Эта процедура соответствует требованиям Закона о фармацевтических препаратах и медицинских изделиях и Постановлению № 169, а также процессу проверки регистрации медицинских изделий в Японии в соответствии со стандартом ISO 13485.
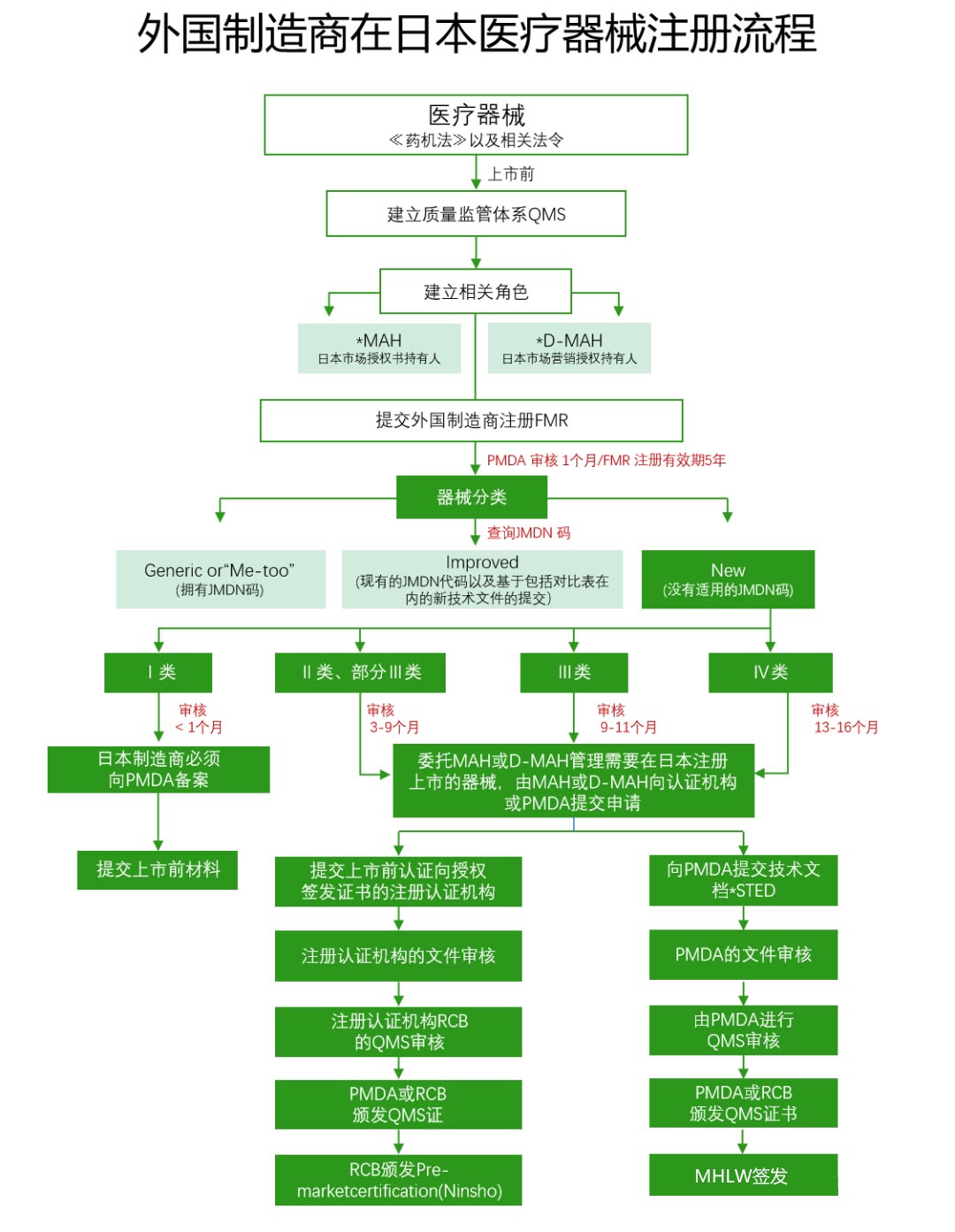
V. Важные моменты
(1) Владелец разрешения на продажу (MAH)/Владелец разрешения на продажу (D-MAH):Иностранные производители обязаны назначить уполномоченного представителя на японском рынке, это является первостепенным условием для продажи медицинских изделий в Японии.
(2) Резюме STED (регистрационные данные):Необходимо включить данные о спецификации продукта, стабильности и сроке годности, данные испытаний производительности, анализ рисков, клинические данные и т.д.
(3) Аудит системы менеджмента качества (QMS):Проводится Управлением по лекарственным средствам и медицинским изделиям (PMDA) или аккредитованным органом (RCB), охватывает все соответствующие места, включая производителей и продавцов, проектирование, производство и т.д. медицинских изделий.
(4) Многочисленные нормативные требования:Медицинские изделия, импортируемые на японский рынок, должны также соответствовать другим нормативным требованиям, таким как Закон о безопасности электрооборудования, Закон о радиосвязи и т.д.


 Следите за обслуживанием клиентов WeChat
Следите за обслуживанием клиентов WeChat